前言
傷口愈合實驗是體外研究細胞遷移的一個有用的實驗。原理是人為的在鋪板的單層細胞中制造一個空白的無細胞的地帶,然后對這個無細胞地帶的邊緣的細胞進行觀察;這些邊緣的細胞會開始進行遷移活動,并且覆蓋整個無細胞的區域,重新互相接觸在一起。
傳統實驗方法
細胞在培養皿內貼壁后,使用移液槍的槍頭在貼壁細胞的中間劃過,人為造成一道傷口(劃痕),之后定時測量劃痕的寬度,進而得到傷口愈合的細胞遷移數據。
實驗缺點:
1.手動劃痕,不能保證每次劃痕的一致;
2.有時候在劃細胞的同時會刮壞一片細胞,對劃痕的邊緣的細胞造成機械損傷;
3.如果培養皿底部還有包被蛋白的話,槍頭劃過,很可能傷害到包被,進而影響到細胞遷移,結果便很難判斷是哪個因素造成了決定性的影響。
4.定時測量劃痕的寬度,計算劃痕寬度隨時間推移的變化;在選取劃痕測量點時,不可避免地引入了主觀誤差(人為選取了遷移結果符合實驗預期的點);
綜上,傳統的傷口愈合方法總是重復性不佳,對于實驗結果的闡述說服力不足。
下面分享一種新方法,輕松得到筆直均一的劃痕!
實驗核心
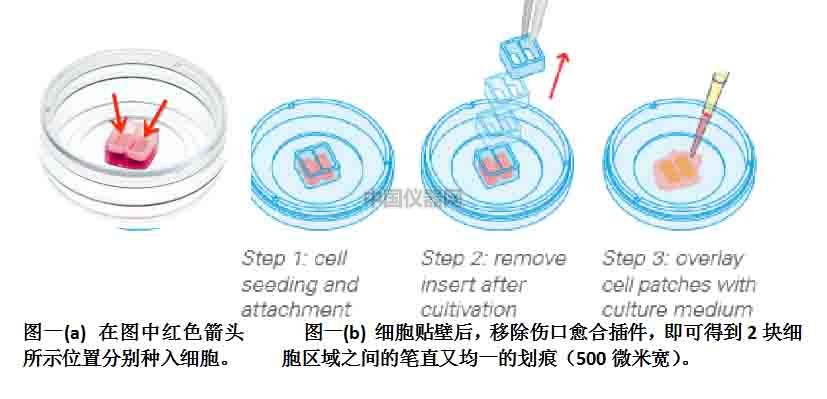
使用傷口愈合插件制造筆直均一的劃痕(圖一)。
實驗方法
一.實驗材料
1) 細胞: MCF-7 (ATCC: HTB-22; DSMZ: ACC115)
2) 實驗耗材: ibidi 35 mm培養皿帶傷口愈合插件(ibidi, 81176) ibiTreat
3) 細胞培養基: RPMI (Sigma, R8758) + 10% FCS (Sigma, F0804)
4) 細胞消化試劑: Trypsin-ETDA (Sigma, 59418C)
5) 滅菌鑷子
6) 倒置顯微鏡,如果需要進行連續的觀測搭配鏡載加熱孵育系統
一.實驗步驟
1.鋪細胞(圖二)
為了獲得更好的實驗結果,在做實驗之前進行一次預實驗,以確定需要使用的細胞懸液的密度。我們建議,將細胞懸液密度調整為24小時后正好可以長滿每個插件的小孔。
● 將ibidi傷口愈合培養皿底部的保護膠帶撕除。
● 準備細胞懸液,調整懸液濃度為3*105 cells/ml,這樣24小時后,細胞能剛剛長滿單個小孔。
● 在ibidi細胞插件的每孔中加入70μl的細胞懸液。注意不要大力晃動培養皿。以防止細胞不均勻。
● 在37。C培養箱中孵育24小時。

圖二:A. 去除培養皿底部的保護膠帶。B.C.在ibidi傷口愈合插件中加入細胞。
1.形成“劃痕”
當所有細胞都貼壁并且剛剛長滿的時候,就可以開始傷口愈合實驗了。用鑷子將傷口愈合插件提出,之后加入新鮮的培養基,或者在培養基中加入刺激劑,然后觀察傷口愈合的情況。
● 24小時后對細胞前一天種的細胞做鏡檢。細胞要貼壁并且是剛剛長滿每個孔。長得過多移除插件時會帶走很多細胞,長得過少,傷口愈合的效果很差。
● 如圖三所示,小心的用鑷子夾住插件的一個角,將插件移除。
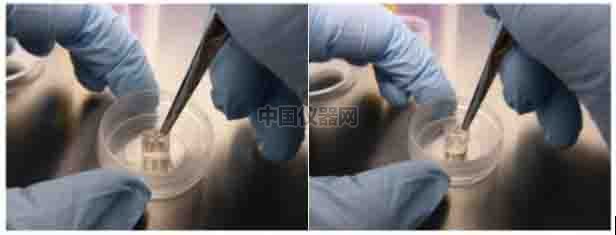
圖三:用鑷子移除插件
● 移除插件后,要用顯微鏡檢查是否形成合格的“劃痕”(圖四)。
● 小心的清洗細胞,之后加入2ml培養基進行培養。

圖四 筆直均一的劃痕
1.采集并分析圖像
一般傷口愈合實驗都是采集一張“劃痕”的初始圖像,再在實驗結束時候采集一張“劃痕”愈合的圖像。我們建議可以在這個過程多做幾個時間點,這樣可以觀測到細胞遷移隨時間的變化特征。
● 在顯微鏡下選取能同時看到“劃痕”和兩邊細胞的視野進行成像,“劃痕”的方向在視野內為水平的或者垂直的。
● MCF-7細胞每半小時采集一張圖片,一直持續到20小時。
● 采用ibidi傷口愈合分析軟件,統計細胞的覆蓋面積,做出曲線圖,可以看到在大約11個小時的時候,細胞基本就已經長滿了,接下來幾個小時細胞覆蓋面積都不會發生變化(圖五)。

圖五(a) 顯微鏡下觀察細胞覆蓋面積的變化
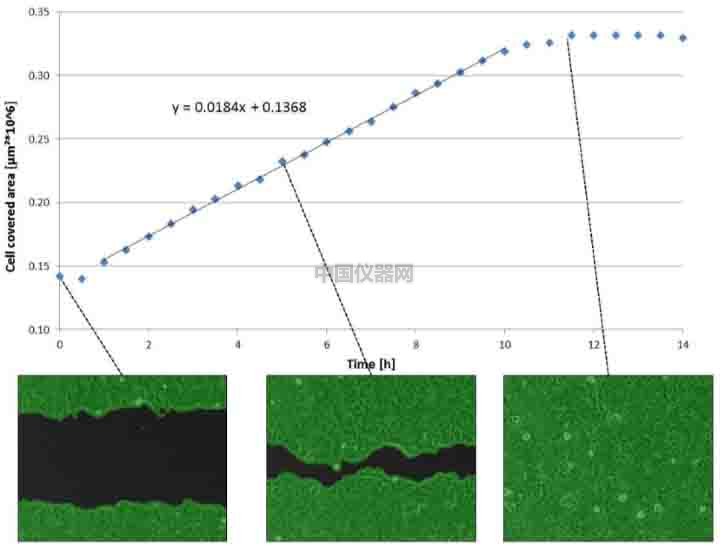
圖五(b) 細胞覆蓋面積的數據統計
實驗總結對比
1.本實驗方法能得到重復性更好的劃痕(圖六);
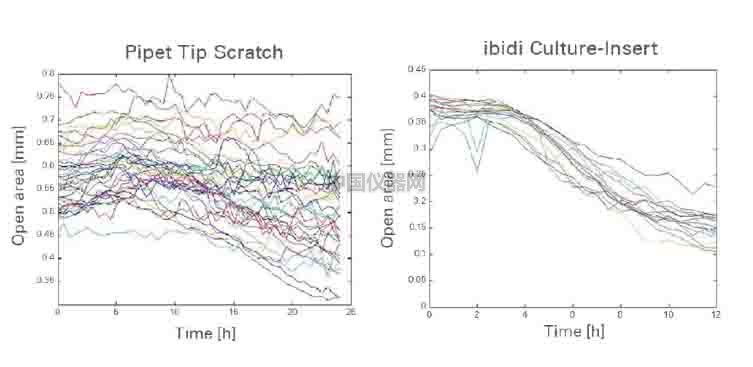
圖六 通過計算劃痕的面積可以看出,在多次實驗中,槍頭劃痕(左圖)
|
制造的劃痕面積數據波動大,重復性差;ibidi傷口愈合插件(右圖)制造的劃痕面積數據統一,重復性良好 |
2.不會刮壞細胞,也不會造成劃痕的邊緣的細胞有機械損傷;
3.不會傷害到培養皿底部的包被蛋白;

圖一:左圖表示槍頭劃過后,底部包被蛋白被劃傷,細胞遷移結果受到底部不均一的影響。右圖ibidi插件移除后底部的包被蛋白沒有被破壞。
4.通過計算細胞覆蓋面積得出細胞遷移結果,避免人為選取測量點,使數據更客觀。1天內就能得到測量結果,實驗分析更快更準確。
|




